云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會于2024年7月成立,設(shè)有獨立的藥物臨床試驗倫理審查委員會辦公室,。倫審查理委員會對藥物臨床試驗項目的科學(xué)性,、倫理合理性進(jìn)行審查,旨在保證研究參與者尊嚴(yán),、安全和權(quán)益,,促進(jìn)藥物臨床試驗科學(xué),、健康地發(fā)展,增強公眾對藥物臨床試驗的信任和支持,。目前倫理審查委員會委員共計9名,,包括:醫(yī)藥專業(yè)人員6名,法律工作者1名,,其他非醫(yī)藥專業(yè)2名,;全體委員中女性4名。
一,、藥物臨床試驗倫理審查委員會人員組成:
主 任 委員:
楊建明 男 云南省精神病醫(yī)院主任醫(yī)師
副主任委員:
賈 榮 男 云南省精神病醫(yī)院主任醫(yī)師
委 員:
鮑天昊 男 云南省精神病醫(yī)院主任醫(yī)師
曾 靜 女 云南省精神病醫(yī)院副主任護師
張海慶 男 云南省精神病醫(yī)院副主任技師
楊春霞 女 云南省精神病醫(yī)院副主任藥師
張文英 女 昆明醫(yī)科大學(xué)倫理教研室
楊生順 男 云南晨昀律師事務(wù)所
普麗輝 女 社會人士
辦公室主任:
鮑天昊 男 云南省精神病醫(yī)院主任醫(yī)師
秘 書:
張夢媛 女 云南省精神病醫(yī)院
二,、藥物臨床試驗倫理審查委員會主要職責(zé):
(一)根據(jù)倫理審查工作的需要,不斷完善倫理審查委員會組織管理和制度建設(shè),,履行保護研究參與者安全,、健康和權(quán)益的職責(zé)。
(二)對申請人提交的藥物床試驗項目的倫理問題進(jìn)行獨立,、公正,、公平和及時的審查。
(三)對本機構(gòu)承擔(dān)實施的所有臨床試驗項目進(jìn)行跟蹤審查和監(jiān)督,。
藥物臨床試驗倫理審查委員會日常行政事務(wù)工作由辦公室主任協(xié)調(diào)處理,,倫理秘書協(xié)助辦公室主任工作。
三,、聯(lián)系方式:
聯(lián)系地址:云南省昆明市盤龍區(qū)穿金路733號4號樓307倫理辦公室
聯(lián)系電話:0871-65610059(正常工作日8:00-17:30)
聯(lián)系人:張夢媛
云南省精神病醫(yī)院
藥物臨床試驗倫理審查委員會章程
第一章 總 則
第一條 為保護研究參與者的權(quán)益和安全,,規(guī)范藥物臨床試驗倫理審查委員會的組織和運作,根據(jù)《藥物臨床試驗質(zhì)量管理規(guī)范》(2020年),、《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》(2020年),、《赫爾辛基宣言》、國際醫(yī)學(xué)科學(xué)組織理事會《涉及人類受試者的生物醫(yī)學(xué)研究國際倫理準(zhǔn)則》,、《臨床試驗倫理審查工作指導(dǎo)原則》(2010年),、《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》(2016年)和《涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法》(2023年)等法律、法規(guī)和有關(guān)部門的要求制定本章程,。
第二條 云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會的宗旨是通過對研究項目的科學(xué)性,、倫理合理性進(jìn)行審查,確保研究參與者尊嚴(yán),、安全和權(quán)益得到保護,,促進(jìn)生物醫(yī)學(xué)研究達(dá)到科學(xué)和倫理的高標(biāo)準(zhǔn),增強公眾對研究的信任和支持,。
第二章 組織
第三條 本藥物臨床試驗倫理審查委員會名稱:云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會,。
第四條 地址:云南省昆明市盤龍區(qū)穿金路733號
第五條 組織架構(gòu):藥物臨床試驗倫理審查委員會工作獨立審查,組織架構(gòu)圖如下:
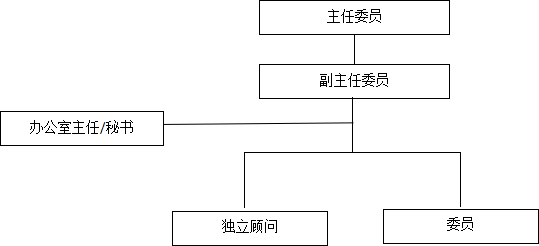
第六條 職責(zé)
藥物臨床試驗倫理審查委員會應(yīng)根據(jù)倫理審查工作的需要不斷完善組織管理和制度建設(shè),,履行保護研究參與者的安全和權(quán)益的職責(zé),。其職責(zé)的履行通過對申請人提交的臨床研究項目的倫理問題進(jìn)行獨立,、公正,、公平和及時審查來實現(xiàn),。主要包括:初始審查、跟蹤審查和簡易程序?qū)彶椤?/span>
第七條 權(quán)力
藥物臨床試驗倫理審查委員會對涉及人的生物醫(yī)學(xué)研究進(jìn)行審查監(jiān)督可以行使如下權(quán)力:
(一)批準(zhǔn)/不批準(zhǔn),;
(二)對批準(zhǔn)的項目進(jìn)行跟蹤審查,;
(三)終止或暫停已經(jīng)批準(zhǔn)的項目。
第八條 行政資源
藥物臨床試驗倫理審查委員會的工作需要醫(yī)院的行政資源支持,,包括:
(一) 獨立的行政匯報關(guān)系,,不受行政級別以及任何研究人員的影響開展獨立公正的倫理審核。獨立指獨立于所審查的項目,,與項目利益相關(guān)的藥物臨床試驗倫理審查委員會人員應(yīng)避免利益沖突,,醫(yī)院行政領(lǐng)導(dǎo)不得通過行政手段干預(yù)藥物臨床試驗倫理審查委員會的工作。
(二) 從行政上確保藥物臨床試驗倫理審查委員會成員有足夠的時間和精力參與藥物臨床試驗倫理審查委員會工作,。
(三) 藥物臨床試驗倫理審查委員會的決議必須能貫徹實施,,研究人員不得違反藥物臨床試驗倫理審查委員會規(guī)定開展相關(guān)臨床試驗工作。
第九條 財政來源:
藥物臨床試驗倫理審查委員會為非營利性機構(gòu),,醫(yī)院在財政上提供相應(yīng)的資助,。財政來源可以是醫(yī)院的撥款,也可以是已經(jīng)被審查項目提交的倫理審查費,。
藥物臨床試驗倫理審查委員會的所有收入不得挪做他用,,只能用于藥物臨床試驗倫理審查委員會自身的建設(shè)發(fā)展(如委員的培訓(xùn)、辦公條件的改善等)和必要的勞務(wù)開支,。
第三章 組建與換屆
第十條 首次組建藥物臨床試驗倫理審查委員會成員由醫(yī)院黨委會推薦,,醫(yī)藥相關(guān)專業(yè)技術(shù)人員在醫(yī)院各專業(yè)專家中選取,其它人員依據(jù)國家《藥物臨床試驗質(zhì)量管理規(guī)范》,、《藥物臨床試驗倫理審查工作指導(dǎo)原則》,、《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》、《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》和《涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法》等有關(guān)藥物臨床試驗倫理審查委員會組成人員的規(guī)定,,由醫(yī)院決定,,所有成員以醫(yī)院正式文件形式任命。
第十一條 藥物臨床試驗倫理審查委員會設(shè)主任委員一名,,副主任委員一名,,首次任命由醫(yī)院指定,換屆時由藥物臨床試驗倫理審查委員會委員選舉產(chǎn)生,。
第十二條 藥物臨床試驗藥物臨床試驗倫理審查委員會設(shè)辦公室主任一名,,負(fù)責(zé)辦公室運行管理工作。設(shè)倫理秘書一名,,負(fù)責(zé)受理倫理審查項目,、安排會議日程,、會議記錄、決議通告,、檔案管理及其他日常工作,。
第十三條 藥物臨床試驗倫理審查委員會根據(jù)所審查研究項目的需要,可聘請獨立顧問,,獨立顧問不參與投票,,僅對所審查項目發(fā)表專業(yè)意見。
第十四條 每屆藥物臨床試驗倫理審查委員會組成人員不少于7人,,且性別均衡,,任期不超過五年,可連選連任,。委員的采取公開征集或由當(dāng)屆委員推薦備選人員,,最終名單由當(dāng)屆倫理委員討論決定,以會議紀(jì)要形式確定,,醫(yī)院正式文件任命,。
第十五條 藥物臨床試驗倫理審查委員會主任委員可根據(jù)委員的工作表現(xiàn)及藥物臨床試驗倫理審查委員會發(fā)展的需求,解聘或增補相關(guān)人員,,解聘或增補均需要超過全體委員的半數(shù)人員同意后方可正式解聘或聘任,。
第四章 工作程序
第十六條 藥物臨床試驗倫理審查委員會應(yīng)本著有益、不傷害,、公正的原則開展倫理審查工作,,保護隱私權(quán)及個人信息,不得受任何不利于研究參與者保護的因素影響,。藥物臨床試驗倫理審查委員會應(yīng)遵循《藥物臨床試驗質(zhì)量管理規(guī)范》(GCP)和世界醫(yī)學(xué)會《赫爾辛基宣言》,、國際醫(yī)學(xué)科學(xué)組織理事會《涉及人類受試者的生物醫(yī)學(xué)研究國際倫理準(zhǔn)則》等相關(guān)的國際倫理準(zhǔn)則,在進(jìn)行臨床試驗倫理審查時,,要以確保研究參與者的權(quán)益,、安全和健康高于對科學(xué)和社會利益的需求為目標(biāo)。
第十七條 藥物臨床試驗倫理審查委員會全體成員必須遵守云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會管理制度和工作流程,,認(rèn)真,、自覺履行崗位職責(zé),積極參加藥物臨床試驗倫理審查委員會安排的會議,,不得無故缺席,、遲到、早退,。并同意公開其姓名,、職業(yè)和隸屬關(guān)系,簽署有關(guān)審查項目,、研究參與者信息和相關(guān)事宜的保密協(xié)議,,利益沖突聲明,。
第十八條 本院牽頭或參與的所有臨床研究項目,須取得藥物臨床試驗倫理審查委員會的會議審查同意并簽署批準(zhǔn)意見后方可實施,,已批準(zhǔn)通過后進(jìn)行方案修訂需根據(jù)修訂情況待藥物臨床試驗倫理審查委員會會議審查或簡易程序?qū)彶榛騻浒竿瓿珊蠓娇蓤?zhí)行修訂后的方案,。
第十九條 申請、受理,、評議,、審定、下達(dá)云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會批復(fù)均應(yīng)遵循云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會的標(biāo)準(zhǔn)操作規(guī)程,,且需要履行書面手續(xù)。
第二十條 藥物臨床試驗倫理審查委員會的審查形式有:會議審查和簡易程序?qū)彶?。按審查?nèi)容可分為:初始審查,、復(fù)審審查、跟蹤審查,、方案修訂審查,、安全性報告審查、方案偏離審查等,。
第二十一條 會議審查時,,要求到會委員數(shù)應(yīng)不少于總委員人數(shù)的三分之二,否則視為無效,。
第二十二條 審評過程要嚴(yán)格保密,,藥物臨床試驗倫理審查委員會所有人員在受聘時均應(yīng)簽署保密協(xié)議及利益沖突聲明。
第二十三條 會議審查后,,藥物臨床試驗倫理審查委員會秘書及時整理會議記錄,,并根據(jù)會議記錄和審查意見形成書面?zhèn)惱韺彶橐庖?批件。
第二十四條 藥物臨床試驗倫理審查委員會主任委員簽發(fā)倫理審查批件/意見,,加蓋藥物臨床試驗倫理審查委員會公章,。對于否定性的決議,應(yīng)有明確的解釋,。
第二十五條 藥物臨床試驗倫理審查委員會的審查意見有以下幾種:
(一) 同意,;
(二) 作必要修改后同意;
(三) 不同意,;
(四) 終止或暫停已經(jīng)批準(zhǔn)的項目,。
第二十六條 藥物臨床試驗倫理審查委員會主任委員主持倫理審查工作,簽發(fā)倫理批件,。主任委員不能履行其職責(zé)時,,由主任委員指定1名副主任委員來代行主任委員職權(quán)。
第二十七條 藥物臨床試驗倫理審查委員會成員應(yīng)積極參加倫理審查會議,,認(rèn)真履行其職責(zé),。每個委員每年參加的倫理審查會議次數(shù)若少于全年會議的1/3,,視為自動放棄其委員資格,第二年則不再聘其為藥物臨床試驗倫理審查委員會委員,。
第二十八條 委員會例會每半年一次,,遇重要事項由主任委員臨時組織召開。
第二十九條 藥物臨床試驗倫理審查委員會應(yīng)根據(jù)云南省衛(wèi)健委的管理要求每年3月31日前向省衛(wèi)健委報告上年度倫理審查工作情況,。
第三十條 藥物臨床試驗倫理審查委員會成員不得向其所審查的研究項目的利益相關(guān)者索取現(xiàn)金,、有價證券和禮品等任何不正當(dāng)?shù)慕?jīng)濟利益。
第五章 附則
第三十一條 本章程的標(biāo)準(zhǔn)操作規(guī)程另行制定,。
第三十二條 本章程自2024年8月22日起執(zhí)行,。
第三十三條 本章程由云南省精神病醫(yī)院藥物臨床試驗倫理審查委員會負(fù)責(zé)解釋。
倫理會議審查申請與受理流程
(一) 電子版資料提交
1.申請者遞交資料需先將電子版資料發(fā)至倫理審查委員會辦公室郵箱,,經(jīng)倫理秘書核對無誤郵件回復(fù)后,,再遞交紙質(zhì)資料。
2.倫理委員會接收電子版資料郵箱為:[email protected]
(二) 紙質(zhì)資料遞交與接收
申請者按照倫理會議審查要求遞交紙質(zhì)資料,,填寫倫理審查申請書,,倫理秘書核對無誤后簽署接收回執(zhí)。
(三) 倫理審查費用
1. 倫理審查費以現(xiàn)金或匯款形式交至醫(yī)院財務(wù)部,,匯款請注明云南省精神病醫(yī)院項目倫理審查費,;
2. 醫(yī)院財務(wù)科倫理費接收賬號等信息如下:
名 稱:云南省精神病醫(yī)院
賬 號:9360220109000177
開 戶 行:富滇銀行昆明新迎支行
3. 醫(yī)院財務(wù)部開具正式發(fā)票,申請者憑繳費憑證領(lǐng)取發(fā)票,。
(四) 審批時間
倫理審查委員會將擇期安排審查會,,從倫理秘書接收資料到倫理審查一般不超過一個月。
(五) 上會資料準(zhǔn)備
1. 申請者準(zhǔn)備完整審查資料2份,。
2. 簡要審查資料9份,。
3. 確認(rèn)審查匯報人員并制作匯報演講幻燈片(在既定會議審查3天前提交)。
備注:以上資料在既定會議審查前5個工作日提交倫理委審查員會秘書,。
(六) 倫理審查批件
倫理審查批件/意見將在倫理審查會后1周之內(nèi)完成,。
倫理審查申請者向倫理審查委員會提供的文件清單
|
文件名 |
應(yīng)提供份數(shù) |
|
研究材料誠信承諾書 |
1 |
|
倫理審查申請表 |
1 |
|
國家藥品監(jiān)督管理局批準(zhǔn)/備案試驗文件 |
2 |
|
臨床試驗方案的摘要(盡量使用非專業(yè)、非技術(shù)性語言),,可附在方案中 |
9 |
|
臨床試驗方案(注明日期和版本)(主要研究者和申辦者簽名或蓋章) |
9 |
|
研究者手冊(注明日期和版本)(申辦方蓋章) |
9 |
|
知情同意書(應(yīng)注明日期,、版本號,須使用研究參與者能懂的文字) |
9 |
|
對試驗中涉及的倫理問題的說明(如在臨床試驗方案中已做了充分說明則可免報) |
9 |
|
病例報告表,、日記錄卡及其它問卷 |
2 |
|
生物樣本,、信息數(shù)據(jù)的來源證明 |
2 |
|
科學(xué)性論證意見(如適用) |
2 |
|
主要研究者及參加試驗的研究者的簡歷(最新的,有簽名并注明日期) |
2 |
|
為招募研究參與者所使用的各種文字,、影視材料等 |
9 |
|
為研究參與者進(jìn)行知情同意提供給研究參與者了解臨床試驗的書面和/或影視資料(所用的語言,、提供的其他形式的信息,必須是研究參與者能準(zhǔn)確理解的語言和信息,必要時,,可使用其他少數(shù)民族的語言文字) |
9 |
|
對如何獲取研究參與者知情同意過程的說明(可在方案中體現(xiàn)) |
9 |
|
對研究參與者參與臨床試驗是否提供,、如何提供有關(guān)補償?shù)恼f明,包括但不限于醫(yī)療保健的費用及使用(可在方案中體現(xiàn)) |
9 |
|
如申請的試驗項目已獲其他倫理委員會的審查,,應(yīng)提供相應(yīng)文件 |
2 |
|
藥物生產(chǎn)單位資質(zhì)證明文件(GMP證書,、生產(chǎn)許可證等) |
2 |
|
申辦方資質(zhì)證明文件 |
2 |
|
藥物檢驗報告(對照藥與試驗藥) |
2 |
|
項目委托相關(guān)文件 |
2 |
|
前期臨床研究總結(jié)報告或試驗完成的證明件 |
2 |
|
研究成果的發(fā)布形式說明 |
2 |
|
利益沖突申明 |
2 |
注:
1、請按要求提供2套完整版審查資料和9套簡裝版資料(共11套),,并加蓋騎縫章
2,、完整版資料請用黑色打孔文件夾裝訂,簡裝版資料可自行選擇裝訂方式,。