藥物臨床試驗(yàn)倫理審查委員會(huì)信息公示
日期:2025年02月28日 來源:網(wǎng)站編輯 瀏覽:1449次
云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)于2024年7月成立,,設(shè)有獨(dú)立的藥物臨床試驗(yàn)倫理審查委員會(huì)辦公室。倫審查理委員會(huì)對(duì)藥物臨床試驗(yàn)項(xiàng)目的科學(xué)性、倫理合理性進(jìn)行審查,,旨在保證研究參與者尊嚴(yán),、安全和權(quán)益,,促進(jìn)藥物臨床試驗(yàn)科學(xué),、健康地發(fā)展,,增強(qiáng)公眾對(duì)藥物臨床試驗(yàn)的信任和支持,。目前倫理審查委員會(huì)委員共計(jì)9名,,包括:醫(yī)藥專業(yè)人員6名,法律工作者1名,,其他非醫(yī)藥專業(yè)2名,;全體委員中女性4名。
一,、藥物臨床試驗(yàn)倫理審查委員會(huì)人員組成:
主 任 委員:
楊建明 男 云南省精神病醫(yī)院主任醫(yī)師
副主任委員:
賈 榮 男 云南省精神病醫(yī)院主任醫(yī)師
委 員:
鮑天昊 男 云南省精神病醫(yī)院主任醫(yī)師
曾 靜 女 云南省精神病醫(yī)院副主任護(hù)師
張海慶 男 云南省精神病醫(yī)院副主任技師
楊春霞 女 云南省精神病醫(yī)院副主任藥師
張文英 女 昆明醫(yī)科大學(xué)倫理教研室
楊生順 男 云南晨昀律師事務(wù)所
普麗輝 女 社會(huì)人士
辦公室主任:
鮑天昊 男 云南省精神病醫(yī)院主任醫(yī)師
秘 書:
張夢(mèng)媛 女 云南省精神病醫(yī)院
二,、藥物臨床試驗(yàn)倫理審查委員會(huì)主要職責(zé):
(一)根據(jù)倫理審查工作的需要,不斷完善倫理審查委員會(huì)組織管理和制度建設(shè),,履行保護(hù)研究參與者安全,、健康和權(quán)益的職責(zé)。
(二)對(duì)申請(qǐng)人提交的藥物床試驗(yàn)項(xiàng)目的倫理問題進(jìn)行獨(dú)立,、公正,、公平和及時(shí)的審查。
(三)對(duì)本機(jī)構(gòu)承擔(dān)實(shí)施的所有臨床試驗(yàn)項(xiàng)目進(jìn)行跟蹤審查和監(jiān)督,。
藥物臨床試驗(yàn)倫理審查委員會(huì)日常行政事務(wù)工作由辦公室主任協(xié)調(diào)處理,,倫理秘書協(xié)助辦公室主任工作。
三,、聯(lián)系方式:
聯(lián)系地址:云南省昆明市盤龍區(qū)穿金路733號(hào)4號(hào)樓307倫理辦公室
聯(lián)系電話:0871-65610059(正常工作日8:00-17:30)
聯(lián)系人:張夢(mèng)媛
云南省精神病醫(yī)院
藥物臨床試驗(yàn)倫理審查委員會(huì)章程
第一章 總 則
第一條 為保護(hù)研究參與者的權(quán)益和安全,,規(guī)范藥物臨床試驗(yàn)倫理審查委員會(huì)的組織和運(yùn)作,根據(jù)《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(2020年),、《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(2020年),、《赫爾辛基宣言》、國(guó)際醫(yī)學(xué)科學(xué)組織理事會(huì)《涉及人類受試者的生物醫(yī)學(xué)研究國(guó)際倫理準(zhǔn)則》,、《臨床試驗(yàn)倫理審查工作指導(dǎo)原則》(2010年),、《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》(2016年)和《涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法》(2023年)等法律,、法規(guī)和有關(guān)部門的要求制定本章程。
第二條 云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)的宗旨是通過對(duì)研究項(xiàng)目的科學(xué)性,、倫理合理性進(jìn)行審查,,確保研究參與者尊嚴(yán)、安全和權(quán)益得到保護(hù),,促進(jìn)生物醫(yī)學(xué)研究達(dá)到科學(xué)和倫理的高標(biāo)準(zhǔn),,增強(qiáng)公眾對(duì)研究的信任和支持。
第二章 組織
第三條 本藥物臨床試驗(yàn)倫理審查委員會(huì)名稱:云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì),。
第四條 地址:云南省昆明市盤龍區(qū)穿金路733號(hào)
第五條 組織架構(gòu):藥物臨床試驗(yàn)倫理審查委員會(huì)工作獨(dú)立審查,,組織架構(gòu)圖如下:
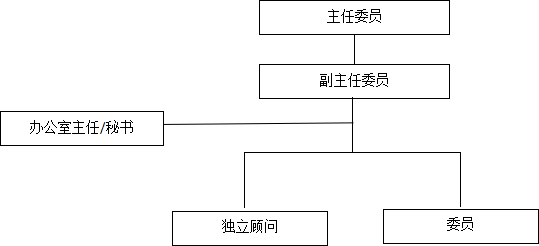
第六條 職責(zé)
藥物臨床試驗(yàn)倫理審查委員會(huì)應(yīng)根據(jù)倫理審查工作的需要不斷完善組織管理和制度建設(shè),履行保護(hù)研究參與者的安全和權(quán)益的職責(zé),。其職責(zé)的履行通過對(duì)申請(qǐng)人提交的臨床研究項(xiàng)目的倫理問題進(jìn)行獨(dú)立,、公正、公平和及時(shí)審查來實(shí)現(xiàn),。主要包括:初始審查,、跟蹤審查和簡(jiǎn)易程序?qū)彶椤?/span>
第七條 權(quán)力
藥物臨床試驗(yàn)倫理審查委員會(huì)對(duì)涉及人的生物醫(yī)學(xué)研究進(jìn)行審查監(jiān)督可以行使如下權(quán)力:
(一)批準(zhǔn)/不批準(zhǔn);
(二)對(duì)批準(zhǔn)的項(xiàng)目進(jìn)行跟蹤審查,;
(三)終止或暫停已經(jīng)批準(zhǔn)的項(xiàng)目,。
第八條 行政資源
藥物臨床試驗(yàn)倫理審查委員會(huì)的工作需要醫(yī)院的行政資源支持,包括:
(一) 獨(dú)立的行政匯報(bào)關(guān)系,,不受行政級(jí)別以及任何研究人員的影響開展獨(dú)立公正的倫理審核,。獨(dú)立指獨(dú)立于所審查的項(xiàng)目,與項(xiàng)目利益相關(guān)的藥物臨床試驗(yàn)倫理審查委員會(huì)人員應(yīng)避免利益沖突,,醫(yī)院行政領(lǐng)導(dǎo)不得通過行政手段干預(yù)藥物臨床試驗(yàn)倫理審查委員會(huì)的工作,。
(二) 從行政上確保藥物臨床試驗(yàn)倫理審查委員會(huì)成員有足夠的時(shí)間和精力參與藥物臨床試驗(yàn)倫理審查委員會(huì)工作。
(三) 藥物臨床試驗(yàn)倫理審查委員會(huì)的決議必須能貫徹實(shí)施,,研究人員不得違反藥物臨床試驗(yàn)倫理審查委員會(huì)規(guī)定開展相關(guān)臨床試驗(yàn)工作,。
第九條 財(cái)政來源:
藥物臨床試驗(yàn)倫理審查委員會(huì)為非營(yíng)利性機(jī)構(gòu),醫(yī)院在財(cái)政上提供相應(yīng)的資助,。財(cái)政來源可以是醫(yī)院的撥款,,也可以是已經(jīng)被審查項(xiàng)目提交的倫理審查費(fèi)。
藥物臨床試驗(yàn)倫理審查委員會(huì)的所有收入不得挪做他用,,只能用于藥物臨床試驗(yàn)倫理審查委員會(huì)自身的建設(shè)發(fā)展(如委員的培訓(xùn),、辦公條件的改善等)和必要的勞務(wù)開支。
第三章 組建與換屆
第十條 首次組建藥物臨床試驗(yàn)倫理審查委員會(huì)成員由醫(yī)院黨委會(huì)推薦,,醫(yī)藥相關(guān)專業(yè)技術(shù)人員在醫(yī)院各專業(yè)專家中選取,,其它人員依據(jù)國(guó)家《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》、《藥物臨床試驗(yàn)倫理審查工作指導(dǎo)原則》,、《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》,、《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》和《涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法》等有關(guān)藥物臨床試驗(yàn)倫理審查委員會(huì)組成人員的規(guī)定,由醫(yī)院決定,,所有成員以醫(yī)院正式文件形式任命,。
第十一條 藥物臨床試驗(yàn)倫理審查委員會(huì)設(shè)主任委員一名,副主任委員一名,,首次任命由醫(yī)院指定,,換屆時(shí)由藥物臨床試驗(yàn)倫理審查委員會(huì)委員選舉產(chǎn)生。
第十二條 藥物臨床試驗(yàn)藥物臨床試驗(yàn)倫理審查委員會(huì)設(shè)辦公室主任一名,,負(fù)責(zé)辦公室運(yùn)行管理工作,。設(shè)倫理秘書一名,負(fù)責(zé)受理倫理審查項(xiàng)目,、安排會(huì)議日程,、會(huì)議記錄、決議通告,、檔案管理及其他日常工作,。
第十三條 藥物臨床試驗(yàn)倫理審查委員會(huì)根據(jù)所審查研究項(xiàng)目的需要,可聘請(qǐng)獨(dú)立顧問,,獨(dú)立顧問不參與投票,,僅對(duì)所審查項(xiàng)目發(fā)表專業(yè)意見。
第十四條 每屆藥物臨床試驗(yàn)倫理審查委員會(huì)組成人員不少于7人,,且性別均衡,,任期不超過五年,可連選連任,。委員的采取公開征集或由當(dāng)屆委員推薦備選人員,,最終名單由當(dāng)屆倫理委員討論決定,以會(huì)議紀(jì)要形式確定,,醫(yī)院正式文件任命,。
第十五條 藥物臨床試驗(yàn)倫理審查委員會(huì)主任委員可根據(jù)委員的工作表現(xiàn)及藥物臨床試驗(yàn)倫理審查委員會(huì)發(fā)展的需求,解聘或增補(bǔ)相關(guān)人員,,解聘或增補(bǔ)均需要超過全體委員的半數(shù)人員同意后方可正式解聘或聘任,。
第四章 工作程序
第十六條 藥物臨床試驗(yàn)倫理審查委員會(huì)應(yīng)本著有益、不傷害,、公正的原則開展倫理審查工作,,保護(hù)隱私權(quán)及個(gè)人信息,不得受任何不利于研究參與者保護(hù)的因素影響,。藥物臨床試驗(yàn)倫理審查委員會(huì)應(yīng)遵循《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(GCP)和世界醫(yī)學(xué)會(huì)《赫爾辛基宣言》,、國(guó)際醫(yī)學(xué)科學(xué)組織理事會(huì)《涉及人類受試者的生物醫(yī)學(xué)研究國(guó)際倫理準(zhǔn)則》等相關(guān)的國(guó)際倫理準(zhǔn)則,在進(jìn)行臨床試驗(yàn)倫理審查時(shí),,要以確保研究參與者的權(quán)益,、安全和健康高于對(duì)科學(xué)和社會(huì)利益的需求為目標(biāo),。
第十七條 藥物臨床試驗(yàn)倫理審查委員會(huì)全體成員必須遵守云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)管理制度和工作流程,認(rèn)真,、自覺履行崗位職責(zé),,積極參加藥物臨床試驗(yàn)倫理審查委員會(huì)安排的會(huì)議,不得無故缺席,、遲到,、早退。并同意公開其姓名,、職業(yè)和隸屬關(guān)系,,簽署有關(guān)審查項(xiàng)目、研究參與者信息和相關(guān)事宜的保密協(xié)議,,利益沖突聲明,。
第十八條 本院牽頭或參與的所有臨床研究項(xiàng)目,須取得藥物臨床試驗(yàn)倫理審查委員會(huì)的會(huì)議審查同意并簽署批準(zhǔn)意見后方可實(shí)施,,已批準(zhǔn)通過后進(jìn)行方案修訂需根據(jù)修訂情況待藥物臨床試驗(yàn)倫理審查委員會(huì)會(huì)議審查或簡(jiǎn)易程序?qū)彶榛騻浒竿瓿珊蠓娇蓤?zhí)行修訂后的方案,。
第十九條 申請(qǐng)、受理,、評(píng)議,、審定、下達(dá)云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)批復(fù)均應(yīng)遵循云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)的標(biāo)準(zhǔn)操作規(guī)程,,且需要履行書面手續(xù),。
第二十條 藥物臨床試驗(yàn)倫理審查委員會(huì)的審查形式有:會(huì)議審查和簡(jiǎn)易程序?qū)彶椤0磳彶閮?nèi)容可分為:初始審查,、復(fù)審審查,、跟蹤審查、方案修訂審查,、安全性報(bào)告審查,、方案偏離審查等。
第二十一條 會(huì)議審查時(shí),,要求到會(huì)委員數(shù)應(yīng)不少于總委員人數(shù)的三分之二,,否則視為無效。
第二十二條 審評(píng)過程要嚴(yán)格保密,,藥物臨床試驗(yàn)倫理審查委員會(huì)所有人員在受聘時(shí)均應(yīng)簽署保密協(xié)議及利益沖突聲明,。
第二十三條 會(huì)議審查后,藥物臨床試驗(yàn)倫理審查委員會(huì)秘書及時(shí)整理會(huì)議記錄,,并根據(jù)會(huì)議記錄和審查意見形成書面?zhèn)惱韺彶橐庖?批件,。
第二十四條 藥物臨床試驗(yàn)倫理審查委員會(huì)主任委員簽發(fā)倫理審查批件/意見,加蓋藥物臨床試驗(yàn)倫理審查委員會(huì)公章。對(duì)于否定性的決議,,應(yīng)有明確的解釋,。
第二十五條 藥物臨床試驗(yàn)倫理審查委員會(huì)的審查意見有以下幾種:
(一) 同意;
(二) 作必要修改后同意,;
(三) 不同意,;
(四) 終止或暫停已經(jīng)批準(zhǔn)的項(xiàng)目,。
第二十六條 藥物臨床試驗(yàn)倫理審查委員會(huì)主任委員主持倫理審查工作,,簽發(fā)倫理批件。主任委員不能履行其職責(zé)時(shí),,由主任委員指定1名副主任委員來代行主任委員職權(quán),。
第二十七條 藥物臨床試驗(yàn)倫理審查委員會(huì)成員應(yīng)積極參加倫理審查會(huì)議,認(rèn)真履行其職責(zé),。每個(gè)委員每年參加的倫理審查會(huì)議次數(shù)若少于全年會(huì)議的1/3,,視為自動(dòng)放棄其委員資格,第二年則不再聘其為藥物臨床試驗(yàn)倫理審查委員會(huì)委員,。
第二十八條 委員會(huì)例會(huì)每半年一次,,遇重要事項(xiàng)由主任委員臨時(shí)組織召開。
第二十九條 藥物臨床試驗(yàn)倫理審查委員會(huì)應(yīng)根據(jù)云南省衛(wèi)健委的管理要求每年3月31日前向省衛(wèi)健委報(bào)告上年度倫理審查工作情況,。
第三十條 藥物臨床試驗(yàn)倫理審查委員會(huì)成員不得向其所審查的研究項(xiàng)目的利益相關(guān)者索取現(xiàn)金,、有價(jià)證券和禮品等任何不正當(dāng)?shù)慕?jīng)濟(jì)利益。
第五章 附則
第三十一條 本章程的標(biāo)準(zhǔn)操作規(guī)程另行制定,。
第三十二條 本章程自2024年8月22日起執(zhí)行,。
第三十三條 本章程由云南省精神病醫(yī)院藥物臨床試驗(yàn)倫理審查委員會(huì)負(fù)責(zé)解釋。
倫理會(huì)議審查申請(qǐng)與受理流程
(一) 電子版資料提交
1.申請(qǐng)者遞交資料需先將電子版資料發(fā)至倫理審查委員會(huì)辦公室郵箱,,經(jīng)倫理秘書核對(duì)無誤郵件回復(fù)后,,再遞交紙質(zhì)資料。
2.倫理委員會(huì)接收電子版資料郵箱為:[email protected]
(二) 紙質(zhì)資料遞交與接收
申請(qǐng)者按照倫理會(huì)議審查要求遞交紙質(zhì)資料,,填寫倫理審查申請(qǐng)書,,倫理秘書核對(duì)無誤后簽署接收回執(zhí)。
(三) 倫理審查費(fèi)用
1. 倫理審查費(fèi)以現(xiàn)金或匯款形式交至醫(yī)院財(cái)務(wù)部,,匯款請(qǐng)注明云南省精神病醫(yī)院項(xiàng)目倫理審查費(fèi),;
2. 醫(yī)院財(cái)務(wù)科倫理費(fèi)接收賬號(hào)等信息如下:
名 稱:云南省精神病醫(yī)院
賬 號(hào):9360220109000177
開 戶 行:富滇銀行昆明新迎支行
3. 醫(yī)院財(cái)務(wù)部開具正式發(fā)票,申請(qǐng)者憑繳費(fèi)憑證領(lǐng)取發(fā)票,。
(四) 審批時(shí)間
倫理審查委員會(huì)將擇期安排審查會(huì),,從倫理秘書接收資料到倫理審查一般不超過一個(gè)月。
(五) 上會(huì)資料準(zhǔn)備
1. 申請(qǐng)者準(zhǔn)備完整審查資料2份,。
2. 簡(jiǎn)要審查資料9份,。
3. 確認(rèn)審查匯報(bào)人員并制作匯報(bào)演講幻燈片(在既定會(huì)議審查3天前提交)。
備注:以上資料在既定會(huì)議審查前5個(gè)工作日提交倫理委審查員會(huì)秘書,。
(六) 倫理審查批件
倫理審查批件/意見將在倫理審查會(huì)后1周之內(nèi)完成,。
倫理審查申請(qǐng)者向倫理審查委員會(huì)提供的文件清單
|
文件名 |
應(yīng)提供份數(shù) |
|
研究材料誠(chéng)信承諾書 |
1 |
|
倫理審查申請(qǐng)表 |
1 |
|
國(guó)家藥品監(jiān)督管理局批準(zhǔn)/備案試驗(yàn)文件 |
2 |
|
臨床試驗(yàn)方案的摘要(盡量使用非專業(yè),、非技術(shù)性語言),可附在方案中 |
9 |
|
臨床試驗(yàn)方案(注明日期和版本)(主要研究者和申辦者簽名或蓋章) |
9 |
|
研究者手冊(cè)(注明日期和版本)(申辦方蓋章) |
9 |
|
知情同意書(應(yīng)注明日期,、版本號(hào),,須使用研究參與者能懂的文字) |
9 |
|
對(duì)試驗(yàn)中涉及的倫理問題的說明(如在臨床試驗(yàn)方案中已做了充分說明則可免報(bào)) |
9 |
|
病例報(bào)告表、日記錄卡及其它問卷 |
2 |
|
生物樣本,、信息數(shù)據(jù)的來源證明 |
2 |
|
科學(xué)性論證意見(如適用) |
2 |
|
主要研究者及參加試驗(yàn)的研究者的簡(jiǎn)歷(最新的,,有簽名并注明日期) |
2 |
|
為招募研究參與者所使用的各種文字、影視材料等 |
9 |
|
為研究參與者進(jìn)行知情同意提供給研究參與者了解臨床試驗(yàn)的書面和/或影視資料(所用的語言,、提供的其他形式的信息,,必須是研究參與者能準(zhǔn)確理解的語言和信息,必要時(shí),,可使用其他少數(shù)民族的語言文字) |
9 |
|
對(duì)如何獲取研究參與者知情同意過程的說明(可在方案中體現(xiàn)) |
9 |
|
對(duì)研究參與者參與臨床試驗(yàn)是否提供,、如何提供有關(guān)補(bǔ)償?shù)恼f明,包括但不限于醫(yī)療保健的費(fèi)用及使用(可在方案中體現(xiàn)) |
9 |
|
如申請(qǐng)的試驗(yàn)項(xiàng)目已獲其他倫理委員會(huì)的審查,,應(yīng)提供相應(yīng)文件 |
2 |
|
藥物生產(chǎn)單位資質(zhì)證明文件(GMP證書,、生產(chǎn)許可證等) |
2 |
|
申辦方資質(zhì)證明文件 |
2 |
|
藥物檢驗(yàn)報(bào)告(對(duì)照藥與試驗(yàn)藥) |
2 |
|
項(xiàng)目委托相關(guān)文件 |
2 |
|
前期臨床研究總結(jié)報(bào)告或試驗(yàn)完成的證明件 |
2 |
|
研究成果的發(fā)布形式說明 |
2 |
|
利益沖突申明 |
2 |
注:
1、請(qǐng)按要求提供2套完整版審查資料和9套簡(jiǎn)裝版資料(共11套),,并加蓋騎縫章
2,、完整版資料請(qǐng)用黑色打孔文件夾裝訂,簡(jiǎn)裝版資料可自行選擇裝訂方式,。



